Introduzione
I recenti progressi nel trattamento dell’artrite idiopatica giovanile (AIG), in particolare l’introduzione delle terapie biotecnologiche, hanno reso possibile il raggiungimento dello stato di malattia inattiva nella maggior parte dei pazienti e hanno permesso di ridurre drammaticamente il danno articolare ed extra-articolare conseguente alla malattia.
L’ampiezza dell’armamentario di farmaci a disposizione, tuttavia, ha reso ancor più complesso il compito del reumatologo pediatra, il quale deve decidere non solo quale sequenza di farmaci adottare per il singolo paziente, ma anche quale siano i tempi ottimali per l’eventuale avvicendamento dei farmaci. Un’ulteriore difficoltà deriva dal fatto che, con poche eccezioni, la maggior parte delle strategie impiegate nel trattamento dell’AIG si basano su evidenze derivate dal trattamento dell’adulto con artrite reumatoide e poche sono le innovazioni nate nel campo della reumatologia pediatrica.
Un ulteriore miglioramento dell’efficacia dei trattamenti per l’AIG continua ad essere necessario, in quanto, sebbene nella maggior parte dei casi un ottimale controllo della malattia sia oggi raggiungibile, una quota significativa di bambini e ragazzi non riesce a raggiungere una remissione stabile in assenza di terapia.
La scelta del trattamento iniziale
Storicamente, l’approccio terapeutico nell’artrite idiopatica giovanile si è basato su step successivi di intervento, con il primo livello rappresentato spesso dai farmaci antinfiammatori non steroidei (FANS). In caso di mancata risposta, viene considerato il ricorso a livelli successivi di intervento, come i corticosteroidi per via sistemica o intra-articolare, il metotrexato o altri disease modifying antirheumatic drugs (DMARDs) che hanno rimpiazzato farmaci non più utilizzati come la penicillamina o i sali d’oro. Solo in terza linea vengono considerati nuovi farmaci biotecnologici. Evidenze sempre maggiori sull’efficacia e sulla sicurezza dei farmaci immunosppressori tradizionali e biotecnologici hanno recentemente permesso di mettere in discussione questo dogma.
I sostenitori di un approccio terapeutico più aggressivo si basano soprattutto sul concetto di “window of opportunity”: una fase precoce nella storia naturale della malattia in cui un intervento farmacologico più vigoroso possa alterare la biologia della malattia, migliorare la prognosi a lungo termine, con la possibilità di prevenire il danno articolare e la riduzione della capacità funzionale (1).
Nell’artrite poliarticolare, le prime evidenze di un possibile beneficio dell’avvio precoce di una terapia biologica sono giunte dallo studio finlandese ACUTE-JIA (2), che ha mostrato come una terapia di prima linea con metotrexato ed infliximab fosse più efficace nel permettere il raggiungimento dello stato di malattia inattiva o di minima attività di malattia, rispetto ad un trattamento con metotrexato in monoterapia o di un trattamento combinato con metotrexato, sulfasalazina ed idrossiclorochina. Il trial nordamericano TREAT (3) non è riuscito invece a dimostrare la superiorità di un trattamento combinato con metotrexato ed etanercept sulla monoterapia con metotrexato: il mancato raggiungimento dell’endpoint primario era però in parte dovuto ad uno sbilanciamento dei due gruppi di trattamento, con pazienti con malattia significativamente più severa nel gruppo trattato con etanercept.
Più recentemente, il trial olandese “BeST for Kids” (4) ha confrontato in pazienti non precedentemente trattati tre diversi approcci terapeutici: una monoterapia sequenziale con metotrexato o sulfasalazina, la combinazione di metotrexato ed etanercept, ed il trattamento con metotrexato associato ad un breve ciclo di terapia steroidea. In questo studio, i tre approcci terapeutici si sono dimostrati egualmente molto efficaci nel permettere il raggiungimento dello stato di malattia inattiva, senza significative differenze. Vedremo più avanti quali sono state le conclusioni tratte dagli Autori da questi risultati.
Nel 2021 sono stati pubblicati i risultati dello studio multicentrico nordamericano STOP-JIA (5). In questo caso, non si è trattato di un trial ma di uno studio prospettico con oltre 400 bambini affetti da AIG poliarticolare, non precedentemente trattati. I medici partecipanti allo studio hanno potuto scegliere per i pazienti arruolati tra tre consensus treatment plan (CTP) per il trattamento iniziale. Il primo CTP prevedeva l’avvio di una monoterapia con DMARD sintetico, il secondo CTP una monoterapia iniziale con farmaco biologico, il terzo una terapia iniziale combinata di DMARD biologico e sintetico. In tutti i CTP il trattamento veniva modulato a seconda del raggiungimento degli endpoint previsti a 3 ed a 6 mesi. L’analisi dei risultati non ha dimostrato la superiorità di un CTP rispetto agli altri, anche dopo aggiustamento mediante propensity score per la diversa severità di malattia dei pazienti nei tre gruppi. Un’analisi secondaria dei dati ha identificato tra i pazienti tre diverse “traiettorie” nell’andamento di malattia per i pazienti arruolati (6). Nell’analisi multivariata, l’unico parametro significativamente associato ad una traiettoria più favorevole è risultato essere l’avvio precoce di una terapia bioteconologica.
È attualmente ancora in corso il trial multicentrico italiano “STARS” (7), anch’esso avente come obiettivo il confronto di due strategie terapeutiche nel trattamento di bambini con AIG all’esordio. In questo caso sono inclusi anche soggetti con artrite oligoarticolare ed il trattamento iniziale è modulato sulla base della severità dell’artrite. Il braccio di trattamento denominato “Step up” prevede un trattamento iniziale con infiltrazioni articolari o metotrexato ed una progressiva intensificazione del trattamento in base al raggiungimento di determinati endpoint. Il braccio “Step down” prevede un ciclo di terapia combinata per 6 mesi. L’endpoint primario è il confronto della frequenza di raggiungimento a 12 mesi della remissione clinica, cioè uno stato di malattia inattiva persistente per almeno sei mesi.
Per l’artrite sistemica, le evidenze a favore di un’efficacia del trattamento biotecnologico precoce sembrano essere più convincenti, sebbene non siano disponibili i risultati di trial randomizzati. Secondo la cosiddetta “ipotesi bifasica”, l’artrite sistemica inizierebbe come una sindrome da disregolazione immunitaria caratterizzata da livelli elevati di citochine, come IL-1. Questo ambiente proinfiammatorio sarebbe successivamente in grado di distorcere l’equilibrio tra linfociti T effettori e regolatori, promuovendo la selezione di una popolazione di linfociti responsabile della cronicità della patologia (8). In uno studio prospettico olandese, il trattamento iniziale in monoterapia con l’antagonista recettoriale dell’IL-1 (Anakinra) ha portato al raggiungimento dello stato di malattia inattiva nell’85% dei casi a 3 mesi dall’avvio del trattamento (9). Analoghi risultati sono stati evidenziati in uno studio retrospettivo italiano ove la durata della malattia (dall’esordio all’inizio della terapia) influenzava fortemente la risposta al trattamento: i pazienti che iniziavano Anakinra dopo 3 mesi dall’esordio della malattia avevano un rischio 8 volte maggiore di non risposta a 6 mesi (10). Infine, uno studio nordamericano basato sul confronto di CTP per l’artrite sistemica ha recentemente terminato l’arruolamento; i risultati non sono al momento disponibili (11).
Adattare la terapia all’andamento clinico
Una volta avviato il trattamento, molteplici rimangono le possibili modalità di prosecuzione della cura. La scelta della strategia terapeutica (cioè tempi e modi di modifica della terapia) è interamente affidata al reumatologo pediatra che deve prendere delle decisioni basate più sull’esperienza che sulle modeste evidenze scientifiche disponibili.
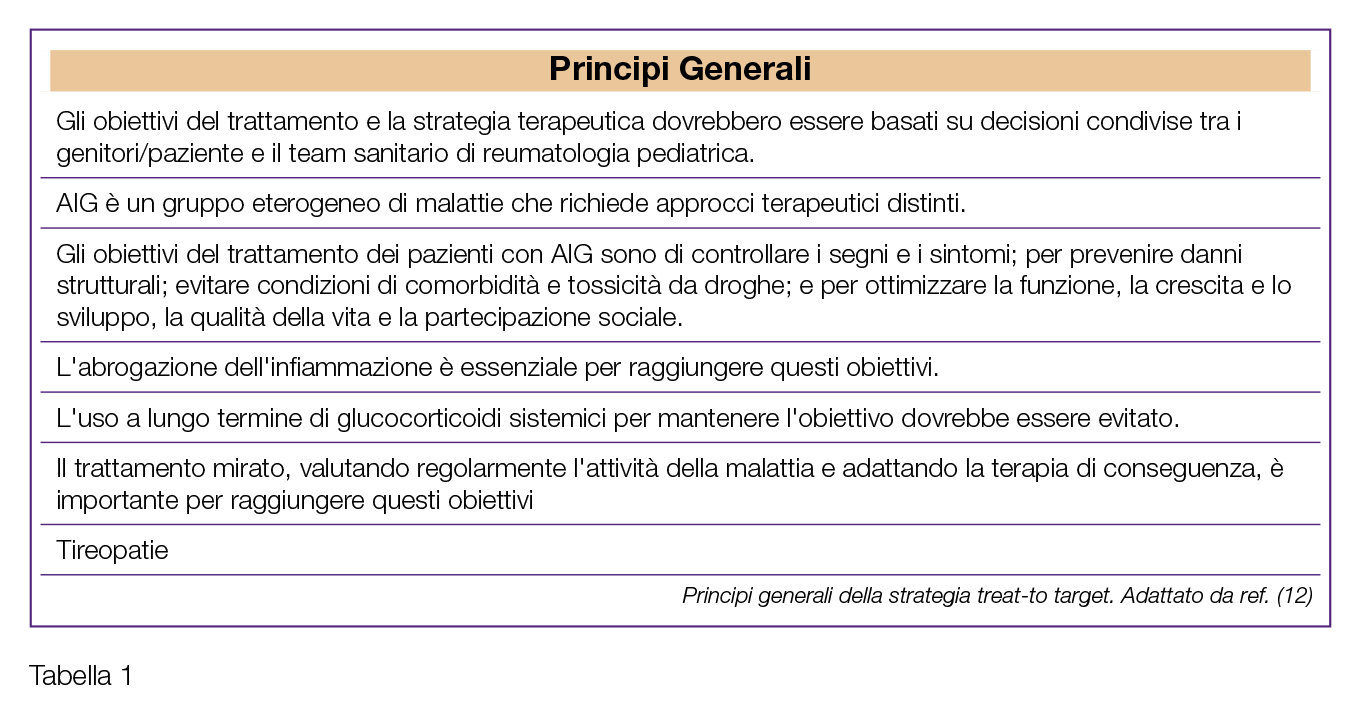
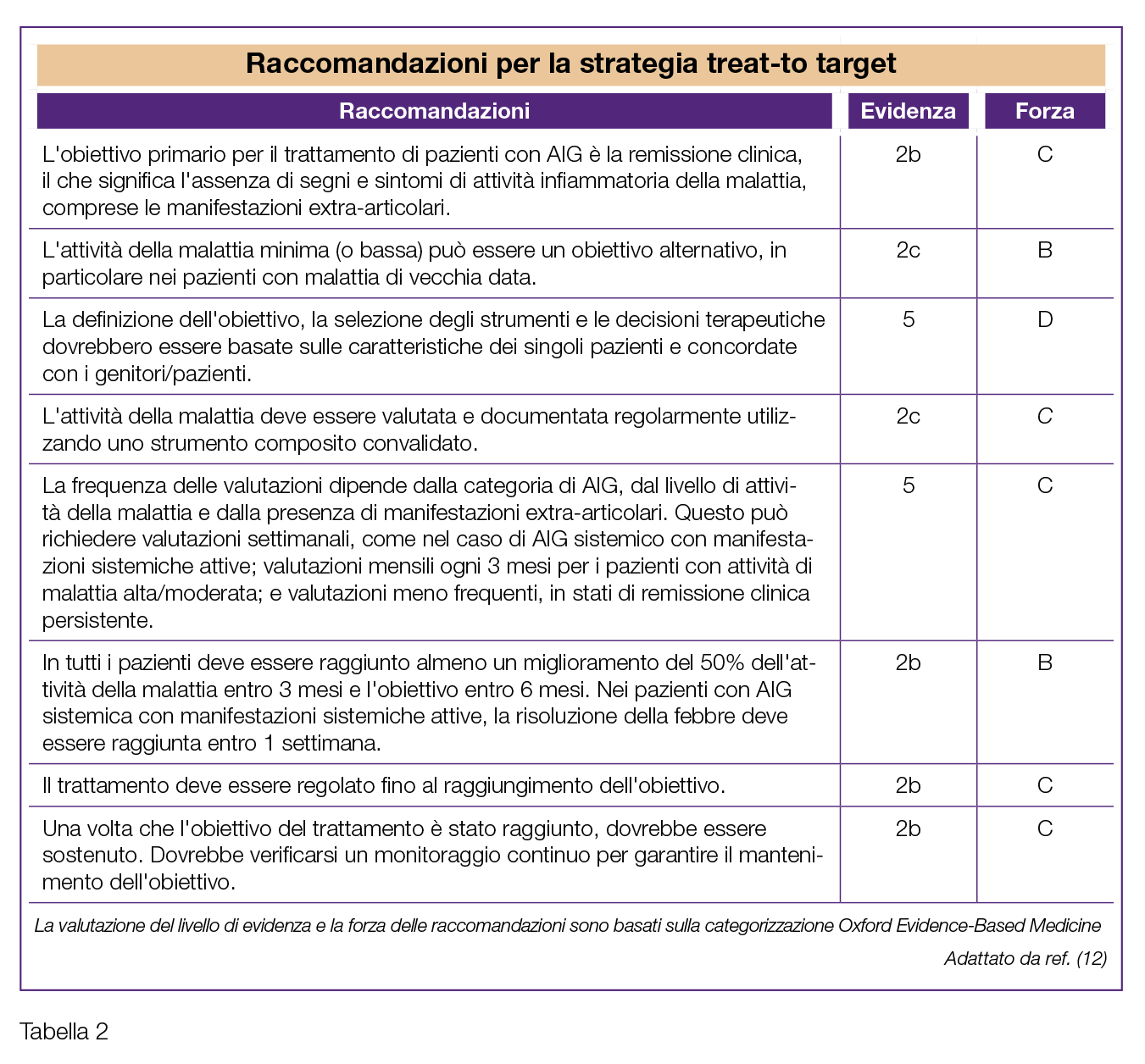
Nell’ultima decade, sempre maggiore consenso sta incontrando anche per l’artrite giovanile l’approccio denominato “treat-to-target” (T2T); le prime raccomandazioni per il T2T nell’AIG sono state pubblicate nel 2018 (12) (Tabelle 1 e 2). La strategia T2T prevede:
- a) La definizione, in accordo con il paziente (o genitore), di quali siano gli obiettivi del trattamento;
- b) Lo stretto monitoraggio del livello di attività di malattia del paziente mediante misure di outcome standardizzate;
- c) La modifica della terapia qualora gli obiettivi del trattamento non vengano raggiunti nei tempi pre-stabiliti.
La maggior parte degli studi sull’AIG basati sul T2T hanno utilizzato come misura di outcome per il monitoraggio dell’attività di malattia il juvenile arthritis disease activity score (JADAS), un punteggio composito che comprende la conta delle articolazioni attive, la valutazione dell’attività di malattia da parte del genitore/paziente e del medico, la velocità di sedimentazione degli eritrociti come indice di fase acuta (13). Gli stati di malattia basati su JADAS possono servire come obiettivi del trattamento (14).
Le principali evidenze a supporto della strategia T2T per l’AIG, giungono dall’analisi secondaria dello studio “BeST for Kids” (4). Gli Autori concludono infatti che la notevole efficacia dei tre approcci terapeutici confrontati, indipendentemente dal braccio di trattamento, sia dovuta al fatto che tutti i pazienti siano stati trattati con un approccio di tipo T2T. Il 70% dei bambini, infatti, ha raggiunto lo stato di malattia inattiva e quasi il 40% dei soggetti è riuscito a sospendere i trattamenti a 24 mesi.
L’altra faccia della medaglia è rappresentata dal possibile aumento dei costi economici legato a questo approccio: nello studio infatti oltre il 50% dei pazienti arruolati è stato trattato con farmaci biotecnologici. Non sono invece emerse preoccupazioni relativamente alla sicurezza delle terapie, ma solo studi a lungo termine potranno portare solide evidenze.
Tutte le nuove raccomandazioni e le linee guida per il trattamento dell’AIG raccomandano l’implementazione di una strategia T2T, incluse le linee guida tedesche pubblicate recentemente (15).
Ridurre la terapia nel paziente in remissione
Per i pazienti che raggiungono e mantengono lo stato di malattia inattiva in corso di terapia, capire quando ridurre o sospendere il trattamento, per evitare di sottoporre il paziente a terapie farmacologiche non necessarie, senza però compromettere il controllo della malattia, rimane una scelta complessa ed influenzata da molte variabili. Il rischio di una ricaduta dopo il raggiungimento della malattia clinicamente inattiva è elevato e, sebbene il ritorno alla remissione dopo la ricaduta è possibile per la maggior parte dei pazienti, questo rappresenta un fardello importante che ha un impatto significativo sulla qualità di vita dei pazienti.
Nuovi studi stanno cercando di capire se esista una fase di attività di malattia non clinicamente evidente, ma evidenziabile mediante l’utilizzo di biomarcatori molecolari o mediante tecniche di imaging (Figura 1). Questo permetterebbe di distinguere i pazienti a maggior rischio di ricaduta che non dovrebbero essere sottoposti a riduzione della terapia anche se clinicamente in remissione
Il trial PREVENT-JIA (16) ha confrontato una coorte di 100 pazienti con AIG ai quali è stata applicata una strategia di riduzione del trattamento basata sui biomarcatori con una coorte retrospettiva in cui la terapia è stata ridotta solo sulla base della valutazione clinica. Per i pazienti nel braccio sperimentale, una volta raggiunta la remissione clinica per sei mesi in corso di trattamento, la terapia veniva interrotta solo se la proteina C reattiva ad alta sensibilità e la proteina S100A12 erano entrambe al di sotto di una determinata soglia. La frequenza cumulativa di ricadute è risultata inferiore nel braccio sperimentale, seppure con un hazard ratio di 0,62 (95% CI 0,38-0,99), ai limiti della significatività statistica.
Altri studi sono in corso, alcuni dei quali utilizzando l’ecografia per guidare una più efficace riduzione della terapia in corso, altri combinando radiologia e biomarcatori molecolari.
Conclusioni
Nuovi studi aiutano il reumatologo pediatra nell’ottimizzazione della cura del bambino con artrite idiopatica giovanile. Le evidenze a favore di una maggiore efficacia del trattamento precoce con farmaci biotecnologici sono ancora deboli, sia per l’artrite poliarticolare che per l’artrite sistemica. Una volta avviato il trattamento, uno stretto monitoraggio con misure di outcome standardizzate è fortemente raccomandato e qualora gli obiettivi del trattamento non vengano raggiunti, è fortemente raccomandata la modifica del trattamento, secondo la strategia treat-to-target. Se viene raggiunto e mantenuto lo stato di malattia clinicamente inattiva, è opportuno ridurre il trattamento farmacologico; biomarcatori molecolari e tecniche di imaging probabilmente aiuteranno il clinico ad identificare i soggetti in cui una sospensione precoce del trattamento potrebbe portare ad un rischio elevato di ricaduta.
Bibliografia
- Hinze C, Gohar F, Foell D. Management of juvenile idiopathic arthritis: hitting the target. Nat Rev Rheumatol. 2015;11(5):290–300.
- Tynjälä P, Vähäsalo P, Tarkiainen M, Kröger L, Aalto K, Malin M, et al. Aggressive combination drug therapy in very early polyarticular juvenile idiopathic arthritis (ACUTE-JIA): a multicentre randomised open-label clinical trial. Ann Rheum Dis. 2011;70(9):1605–12.
- Wallace CA, Giannini EH, Spalding SJ, Hashkes PJ, O’Neil KM, Zeft AS, et al. Trial of early aggressive therapy in polyarticular juvenile idiopathic arthritis. Arthritis Rheum. 2012;64(6):2012–21.
- Hissink Muller PCE, Brinkman DMC, Schonenberg D, Koopman-Keemink Y, Brederije ICJ, Bekkering WP, et al. A comparison of three treatment strategies in recent onset non-systemic Juvenile Idiopathic Arthritis: initial 3-months results of the BeSt for Kids-study. Pediatr Rheumatol. 2017;15(1):11.
- Kimura Y, Schanberg LE, Tomlinson GA, Riordan ME, Dennos AC, Del Gaizo V, et al. Optimizing the Start Time of Biologics in Polyarticular Juvenile Idiopathic Arthritis: A Comparative Effectiveness Study of Childhood Arthritis and Rheumatology Research Alliance Consensus Treatment Plans. Arthritis Rheumatol. 2021 Oct;73(10):1898–909.
- Ong MS, Ringold S, Kimura Y, Schanberg LE, Tomlinson GA, Natter MD, et al. Improved Disease Course Associated With Early Initiation of Biologics in Polyarticular Juvenile Idiopathic Arthritis: Trajectory Analysis of a Childhood Arthritis and Rheumatology Research Alliance Consensus Treatment Plans Study. Arthritis Rheumatol Hoboken NJ. 2021 Oct;73(10):1910–20.
- Burrone M, Mazzoni M, Naddei R, Pistorio A, Spelta M, Scala S, et al. Looking for the best strategy to treat children with new onset juvenile idiopathic arthritis: presentation of the “comparison of STep-up and step-down therapeutic strategies in childhood ARthritiS” (STARS) trial. Pediatr Rheumatol Online J. 2022;20(1):80.
- Nigrovic PA. Review: is there a window of opportunity for treatment of systemic juvenile idiopathic arthritis? Arthritis Rheumatol Hoboken NJ. 2014;66(6):1405–13.
- Vastert SJ, de Jager W, Noordman BJ, Holzinger D, Kuis W, Prakken BJ, et al. Effectiveness of first-line treatment with recombinant interleukin-1 receptor antagonist in steroid-naive patients with new-onset systemic juvenile idiopathic arthritis: results of a prospective cohort study. Arthritis Rheumatol Hoboken NJ. 2014;66(4):1034–43.
- Pardeo M, Rossi MN, Pires Marafon D, Sacco E, Bracaglia C, Passarelli C, et al. Early Treatment and IL1RN Single–Nucleotide Polymorphisms Affect Response to Anakinra in Systemic Juvenile Idiopathic Arthritis. Arthritis Rheumatol. 2021;73(6):1053–61.
- Nigrovic PA, Beukelman T, Tomlinson G, Feldman BM, Schanberg LE, Kimura Y, et al. Bayesian comparative effectiveness study of four consensus treatment plans for initial management of systemic juvenile idiopathic arthritis: FiRst-Line Options for Systemic juvenile idiopathic arthritis Treatment (FROST). Clin Trials Lond Engl. 2018;15(3):268–77.
- Ravelli A, Consolaro A, Horneff G, Laxer RM, Lovell DJ, Wulffraat NM, et al. Treating juvenile idiopathic arthritis to target: recommendations of an international task force. Ann Rheum Dis. 2018;77(6):819–28.
- Consolaro A, Ruperto N, Bazso A, Pistorio A, Magni-Manzoni S, Filocamo G, et al. Development and validation of a composite disease activity score for juvenile idiopathic arthritis. Arthritis Rheum. 2009 15;61(5):658–66.
- Trincianti C, Van Dijkhuizen EHP, Alongi A, Mazzoni M, Swart JF, Nikishina I, et al. Definition and Validation of the American College of Rheumatology 2021 Juvenile Arthritis Disease Activity Score Cutoffs for Disease Activity States in Juvenile Idiopathic Arthritis. Arthritis Rheumatol. 2021;73(11):1966–75.
- Oommen PT, Strauss T, Baltruschat K, Foeldvari I, Deuter C, Ganser G, et al. Update of evidence- and consensus-based guidelines for the treatment of juvenile idiopathic arthritis (JIA) by the German Society of Pediatric and Juvenile Rheumatic Diseases (GKJR): New perspectives on interdisciplinary care. Clin Immunol. 2022;245:109143.
- Gerss J, Tedy M, Klein A, Horneff G, Miranda-Garcia M, Kessel C, et al. Prevention of disease flares by risk-adapted stratification of therapy withdrawal in juvenile idiopathic arthritis: results from the PREVENT-JIA trial. Ann Rheum Dis. 2022;81(7):990–7.
Related articles
COVID e MISC-C in età pediatrica: tanti dubbi e poche certezze A distanza di quasi un anno e mezzo dalla comparsa del SARS-COV2 i dati in ambito pediatrico sono ormai cospicui. L’analisi delle casistiche mondiali ha sostanzialmente confermato le prime osservazioni, secondo le quali la polmonite interstiziale è di rara osservazione nella popolazione pediatrica. Pensare > Continua la lettura ...
1. Introduzione Nel dicembre del 2019, in un gruppo di pazienti ricoverati per polmonite a Wuhan, nella provincia cinese di Hubei, è stato isolato per la prima volta il coronavirus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2)1, e nel febbraio del 2020, l’OMS (Organizzazione Mondiale della Sanità) ha definito con il termine di COVID-19 (Coronavirus > Continua la lettura ...
Introduzione L’emergenza sanitaria mondiale legata alla pandemia da COVID-19 ha coinvolto anche i soggetti affetti da patologie reumatologiche. Di base, questi pazienti sono considerati ad incrementato rischio infettivo per l’alterata regolazione del sistema immunitario correlata alla patologia sottostante e per i trattamenti a cui sono sottoposti, basati sull’utilizzo di sostanze ad azione immunomodulante, come i > Continua la lettura ...
Patologie rare in età giovanile e adulta Questo numero di V-Start include tre articoli riguardanti tre patologie molto differenti tra di loro. Il primo contributo riguarda le spondiloartriti giovanili. Si tratta di una revisione dei più recenti dati riguardanti la classificazione, la clinica e la terapia di forme pediatriche che sono incluse nella cosiddetta artrite > Continua la lettura ...